Discusión teórica sobre a proba de estabilidade dos aerosols inducida pola fórmula de Arrhenius
O proceso necesario para que se lancen os nosos produtos en aerosois é facer unha proba de estabilidade, pero descubriremos que aínda que a proba de estabilidade pasou, aínda haberá diferentes graos de fuga de corrosión na produción en masa, ou mesmo problemas de calidade do produto en masa.Entón, aínda é significativo para nós facer unha proba de estabilidade?
Normalmente falamos de 50 ℃ tres meses de proba de estabilidade equivalen a dous anos de ciclo de proba teórica a temperatura ambiente, entón de onde vén o valor teórico?Hai que mencionar aquí unha fórmula notable: a fórmula de Arrhenius.A ecuación de Arrhenius é un termo químico.É unha fórmula empírica da relación entre a constante de velocidade da reacción química e a temperatura.Moita práctica demostra que esta fórmula non só é aplicable á reacción de gas, á reacción en fase líquida e á maior parte da reacción catalítica multifásica.
Escritura de fórmulas (exponencial)
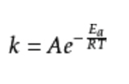
K é a constante de velocidade, R é a constante do gas molar, T é a temperatura termodinámica, Ea é a enerxía de activación aparente e A é o factor pre-exponencial (tamén coñecido como factor de frecuencia).
Cómpre sinalar que a fórmula empírica de Arrhenius asume que a enerxía de activación Ea considérase como unha constante independente da temperatura, o que é consistente cos resultados experimentais dentro dun determinado intervalo de temperatura.Non obstante, debido a un amplo rango de temperaturas ou reaccións complexas, LNK e 1/T non son unha boa liña recta.Mostra que a enerxía de activación está relacionada coa temperatura e que a fórmula empírica de Arrhenius non é aplicable a algunhas reaccións complexas.
Aínda podemos seguir a fórmula empírica de Arrhenius en aerosois?Segundo a situación, séguense a maioría deles, con poucas excepcións, sempre que, por suposto, a "enerxía de activación Ea" do produto en aerosol sexa unha constante estable independente da temperatura.
Segundo a ecuación de Arrhenius, os seus factores de influencia químicos inclúen os seguintes aspectos:
(1) Presión: para reaccións químicas que inclúen gas, cando outras condicións permanecen sen cambios (excepto o volume), aumenta a presión, é dicir, o volume diminúe, a concentración de reactivos aumenta, o número de moléculas activadas por unidade de volume aumenta, o número de as colisións efectivas por unidade de tempo aumentan e a velocidade de reacción acelera;En caso contrario, diminúe.Se o volume é constante, a velocidade de reacción mantense constante a presión (engadindo un gas que non participa na reacción química).Como a concentración non cambia, o número de moléculas activas por volume non cambia.Pero a volume constante, se engades os reactivos, de novo, aplicas presión, e aumentas a concentración dos reactivos, aumentas a velocidade.
(2) Temperatura: mentres se eleve a temperatura, as moléculas reactivas gañan enerxía, polo que parte das moléculas orixinais de baixa enerxía convértense en moléculas activadas, aumentando a porcentaxe de moléculas activadas, aumentando o número de colisións efectivas, polo que a reacción aumentos da taxa (o principal motivo).Por suposto, debido ao aumento da temperatura, a velocidade de movemento molecular é acelerada e o número de colisións moleculares de reactivos por unidade de tempo aumenta e a reacción acelerarase en consecuencia (causa secundaria).
(3) Catalizador: o uso de catalizador positivo pode reducir a enerxía necesaria para a reacción, de xeito que máis moléculas de reactivos se converten en moléculas activadas, mellorando moito a porcentaxe de moléculas de reactivos por unidade de volume, aumentando así a taxa de reactivos miles de veces.O catalizador negativo é o contrario.
(4) Concentración: cando outras condicións son iguais, o aumento da concentración de reactivos aumenta o número de moléculas activadas por unidade de volume, aumentando así a colisión efectiva, a velocidade de reacción aumenta, pero a porcentaxe de moléculas activadas non cambia.
Os factores químicos dos catro aspectos anteriores poden explicar ben a nosa clasificación dos sitios de corrosión (corrosión en fase gaseosa, corrosión en fase líquida e corrosión da interface):
1) Na corrosión en fase gaseosa, aínda que o volume permanece inalterado, a presión aumenta.A medida que aumenta a temperatura, aumenta a activación do aire (osíxeno), auga e propelente e aumenta o número de colisións, polo que se intensifica a corrosión en fase gaseosa.Polo tanto, a selección do inhibidor de ferruxe en fase gaseosa apropiada a base de auga é moi crítica
2) corrosión en fase líquida, debido á activación da concentración aumentada, algunhas impurezas poden (como ións de hidróxeno, etc.) nun enlace débil e os materiais de embalaxe colisión acelerada produciu corrosión, polo que a elección do axente antioxidante en fase líquida debe considerarse coidadosamente combinado con pH e materias primas.
3) A corrosión da interface, combinada coa presión, a catálise de activación, o aire (osíxeno), auga, propelente, impurezas (como ións de hidróxeno, etc.), unha reacción ampla, o que resulta na corrosión da interface, a estabilidade e o deseño do sistema de fórmulas son moi fundamentais. .

Volvendo á pregunta anterior, por que ás veces funciona a proba de estabilidade, pero aínda hai unha anomalía no que se refire á produción en masa?Considere o seguinte:
1: deseño de estabilidade do sistema de fórmulas, como cambio de pH, estabilidade de emulsificación, estabilidade de saturación, etc.
2: existen impurezas na materia prima, como cambios nos ións de hidróxeno e ións cloruro
3: estabilidade dos lotes de materias primas, ph entre lotes de materias primas, tamaño da desviación do contido, etc.
4: a estabilidade das latas e válvulas de aerosois e outros materiais de envasado, a estabilidade do espesor da capa de estaño, a substitución das materias primas causada polo aumento do prezo das materias primas.
5: Analiza coidadosamente cada anomalía na proba de estabilidade, aínda que sexa un pequeno cambio, fai un xuízo razoable mediante a comparación horizontal, a amplificación microscópica e outros métodos (esta é a capacidade que máis carece na industria doméstica de aerosois na actualidade)
Polo tanto, a estabilidade da calidade do produto implica todos os aspectos, e é necesario ter un sistema de calidade completo para controlar todo o porto da cadea de subministración (incluíndo estándares de adquisición, estándares de investigación e desenvolvemento, estándares de inspección, estándares de produción, etc.) para cumprir o estándar de calidade. estratexia, para garantir a estabilidade final e a conformidade dos nosos produtos.
Desafortunadamente, o que queremos compartir na actualidade é que as probas de estabilidade non poden garantir que non haxa problemas nas probas de estabilidade e que a produción en masa non debe ter problemas.Combinando as consideracións anteriores e as probas de estabilidade de cada produto, podemos evitar a gran maioría dos perigos ocultos.Aínda quedan algúns problemas agardando por nós para explorar, descubrir e resolver.Un dos atractivos dos aerosois é que se espera que máis xente resolva máis misterios.
Hora de publicación: 23-Xun-2022





